Exemplo De Reação De Dupla Troca é um conceito fundamental na química, que descreve a troca de íons entre dois reagentes, formando novos produtos. Essas reações são amplamente observadas em diversos processos químicos, desde a produção de alimentos até o tratamento de água, e seu estudo é crucial para a compreensão de muitos fenômenos químicos.
Ao mergulharmos nesse tema, exploraremos o mecanismo por trás das reações de dupla troca, classificaremos seus diferentes tipos, e analisaremos os fatores que influenciam sua ocorrência. Desvendaremos as aplicações práticas dessas reações em diversas áreas, além de apresentar exemplos concretos para ilustrar os conceitos abordados.
Reações de Dupla Troca: Uma Visão Geral: Exemplo De Reação De Dupla Troca
Reações de dupla troca, também conhecidas como reações de metátese, são um tipo comum de reação química que envolve a troca de íons entre dois reagentes. Essas reações desempenham um papel fundamental em diversos processos químicos, tanto na indústria quanto na natureza.
Compreender o mecanismo e os fatores que influenciam as reações de dupla troca é crucial para prever e controlar reações químicas em vários contextos.
Introdução
Em uma reação de dupla troca, os reagentes são geralmente compostos iônicos, que se dissociam em íons em solução. Quando esses reagentes são misturados, os íons trocam de parceiros, formando novos compostos iônicos. A troca de íons ocorre porque os íons positivos (cátions) de um reagente são atraídos pelos íons negativos (ânions) do outro reagente, e vice-versa.
O estudo das reações de dupla troca é crucial na química por várias razões. Primeiro, elas permitem a síntese de uma ampla gama de compostos, incluindo sais, óxidos e hidróxidos. Segundo, as reações de dupla troca são frequentemente usadas em análises químicas para identificar e quantificar íons específicos.
Terceiro, essas reações desempenham um papel importante em processos industriais, como a produção de fertilizantes, a purificação de água e a síntese de medicamentos.
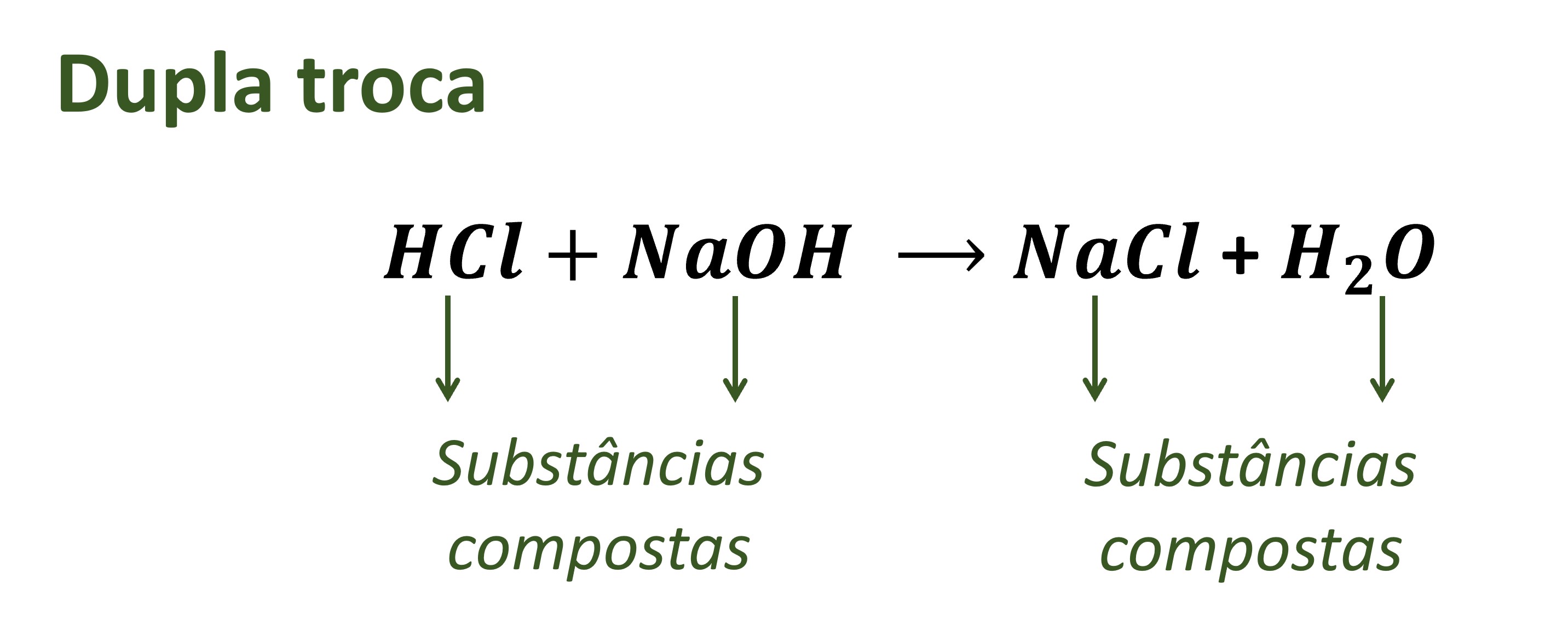
Exemplos práticos de reações de dupla troca ocorrem no nosso dia a dia. Por exemplo, a reação entre ácido clorídrico (HCl) e hidróxido de sódio (NaOH) é uma reação de dupla troca que produz cloreto de sódio (NaCl) e água (H 2O).
Essa reação é a base da neutralização de ácidos e bases.
Mecanismo das Reações de Dupla Troca
O mecanismo de uma reação de dupla troca envolve a troca de íons entre os reagentes. A troca de íons ocorre porque os íons positivos (cátions) de um reagente são atraídos pelos íons negativos (ânions) do outro reagente, e vice-versa.
Isso resulta na formação de novos compostos iônicos.
Para ilustrar o processo de troca de íons, considere a reação entre cloreto de bário (BaCl 2) e sulfato de sódio (Na 2SO 4):
BaCl2(aq) + Na 2SO 4(aq) → BaSO 4(s) + 2NaCl(aq)
Nessa reação, os íons bário (Ba 2+) do cloreto de bário reagem com os íons sulfato (SO 42-) do sulfato de sódio, formando sulfato de bário (BaSO 4), que é um sólido insolúvel. Os íons sódio (Na +) do sulfato de sódio reagem com os íons cloreto (Cl –) do cloreto de bário, formando cloreto de sódio (NaCl), que permanece em solução.
A formação de produtos em uma reação de dupla troca depende da solubilidade dos compostos formados. Se um dos produtos for insolúvel em água, ele precipitará da solução. Se ambos os produtos forem solúveis, a reação resultará em uma solução com íons dissolvidos.
O equilíbrio químico é atingido quando a velocidade da reação direta (formação de produtos) é igual à velocidade da reação inversa (formação de reagentes).
Tipos de Reações de Dupla Troca
As reações de dupla troca podem ser classificadas em diferentes tipos, com base nos produtos formados:
- Reações de precipitação:Nesse tipo de reação, um dos produtos é um composto insolúvel, que precipita da solução. Por exemplo, a reação entre cloreto de bário e sulfato de sódio, mencionada anteriormente, é uma reação de precipitação, pois o sulfato de bário é insolúvel em água.
- Reações de neutralização:As reações de neutralização envolvem a reação entre um ácido e uma base, formando sal e água. Por exemplo, a reação entre ácido clorídrico (HCl) e hidróxido de sódio (NaOH) é uma reação de neutralização, pois produz cloreto de sódio (NaCl) e água (H 2O).
- Reações de formação de gás:Nesse tipo de reação, um dos produtos é um gás. Por exemplo, a reação entre ácido clorídrico (HCl) e carbonato de cálcio (CaCO 3) produz gás carbônico (CO 2), água (H 2O) e cloreto de cálcio (CaCl 2).
Fatores que Influenciam as Reações de Dupla Troca
Vários fatores podem influenciar a ocorrência e a extensão das reações de dupla troca, incluindo:
- Concentração dos reagentes:Aumentar a concentração dos reagentes geralmente aumenta a velocidade da reação. Isso ocorre porque há mais moléculas reagentes disponíveis para colidir e reagir.
- Temperatura:Aumentar a temperatura geralmente aumenta a velocidade da reação. Isso ocorre porque as moléculas se movem mais rápido em temperaturas mais altas, o que aumenta a frequência de colisões e reações.
- Presença de catalisadores:Os catalisadores são substâncias que aceleram a velocidade de uma reação sem serem consumidos no processo. Eles funcionam fornecendo um caminho alternativo com menor energia de ativação para a reação.
A influência desses fatores pode variar em diferentes tipos de reações de dupla troca. Por exemplo, a influência da temperatura é mais pronunciada em reações de precipitação do que em reações de neutralização.
Aplicações das Reações de Dupla Troca
As reações de dupla troca têm uma ampla gama de aplicações práticas em diferentes áreas, incluindo:
- Indústria química:As reações de dupla troca são usadas na produção de uma variedade de produtos químicos, incluindo fertilizantes, pesticidas e medicamentos. Por exemplo, a reação de neutralização entre ácido sulfúrico (H 2SO 4) e amônia (NH 3) é usada na produção de sulfato de amônio (NH 4) 2SO 4, um fertilizante importante.
- Tratamento de água:As reações de dupla troca são usadas para remover íons indesejáveis da água, como íons cálcio (Ca 2+) e magnésio (Mg 2+), que causam dureza da água. Por exemplo, a adição de carbonato de sódio (Na 2CO 3) à água dura causa a precipitação de carbonato de cálcio (CaCO 3) e carbonato de magnésio (MgCO 3), removendo os íons cálcio e magnésio da água.
- Produção de alimentos:As reações de dupla troca são usadas na produção de alimentos, como queijo e iogurte. Por exemplo, a adição de ácido láctico (CH 3CH(OH)COOH) ao leite causa a coagulação das proteínas do leite, formando coalho, que é usado na produção de queijo.
As reações de dupla troca são essenciais para o desenvolvimento de novas tecnologias. Por exemplo, a síntese de novos materiais, como polímeros e cerâmicas, geralmente envolve reações de dupla troca.
Exemplos de Reações de Dupla Troca
| Reagentes | Produtos | Equação Química Balanceada | Tipo de Reação |
|---|---|---|---|
| Cloreto de bário (BaCl2) + Sulfato de sódio (Na2SO4) | Sulfato de bário (BaSO4) + Cloreto de sódio (NaCl) | BaCl2(aq) + Na2SO4(aq) → BaSO4(s) + 2NaCl(aq) | Reação de precipitação |
| Ácido clorídrico (HCl) + Hidróxido de sódio (NaOH) | Cloreto de sódio (NaCl) + Água (H2O) | HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) | Reação de neutralização |
| Ácido clorídrico (HCl) + Carbonato de cálcio (CaCO3) | Cloreto de cálcio (CaCl2) + Gás carbônico (CO2) + Água (H2O) | 2HCl(aq) + CaCO3(s) → CaCl2(aq) + CO2(g) + H2O(l) | Reação de formação de gás |
Frequently Asked Questions
Como posso identificar uma reação de dupla troca?
Uma reação de dupla troca é caracterizada pela troca de íons entre dois reagentes, formando novos produtos. Você pode identificar uma reação de dupla troca observando se os reagentes são compostos iônicos e se há troca de íons entre eles.
Quais são as aplicações mais importantes das reações de dupla troca?
As reações de dupla troca possuem diversas aplicações, incluindo a produção de sais, a neutralização de ácidos, a formação de precipitados, o tratamento de água e a produção de alimentos.

